اسید سولفوریک در واقع یک مایع بدون رنگ روغنی است که نسبت به فلزات خورنده میباشد. این اسید قوی در صورتی که در تماس با چوب یا مواد آلی قرار بگیرد، باعث خوردگی آنها میشود اما احتمال آتشسوزی بسیار پایین است. علاوه بر این، قرار گرفتن در معرض این اسید میتواند برای سلامتی انسان نیز مضر باشد.
با این وجود، این اسید در صنایع مختلف بسیار پرکاربرد است. به عنوان مثال، از اسید سولفوریک در تهیهی انواع کودها و شویندهها استفاده میشود. از دیگر کاربردهای آن میتوان به ساخت رنگهای مختلف و همچنین، حذف خوردگی از فلزات اشاره کرد. در این مطلب، در مورد اسید سولفوریک، خواص و کاربردهای آن به طور گسترده صحبت خواهیم کرد.
اسید سولفوریک چیست؟
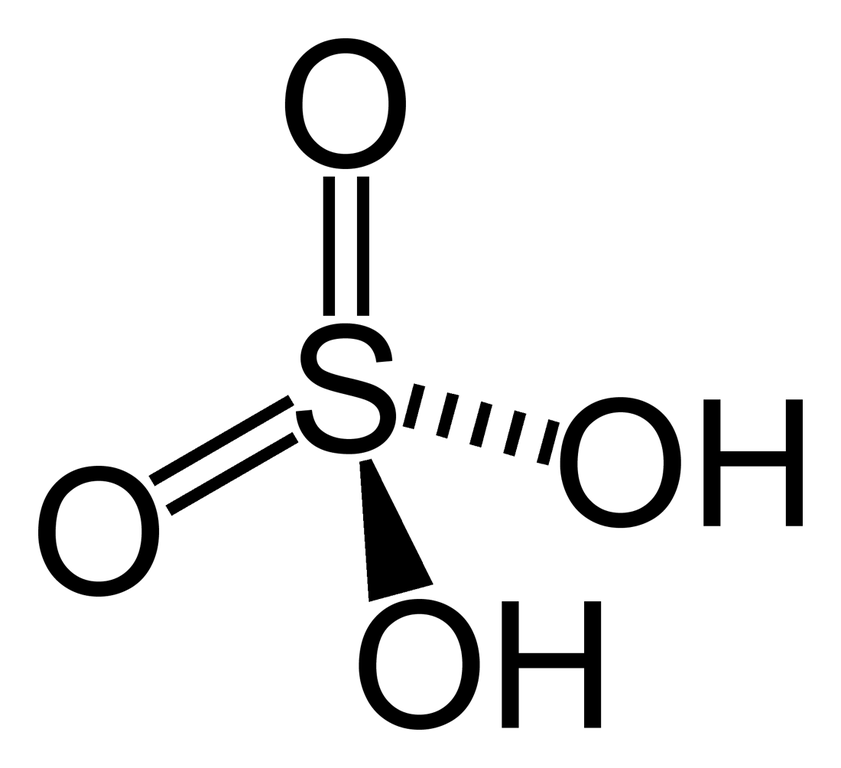
اسید سولفوریک از پیوند کوالانسی بین دو گروه اکسو و دو هیدروکسی با یک اتم گوگرد مرکزی به دست میآید. اسید سولفوریک را میتوان یک اسید گوگرد آب دوست در نظر گرفت. لازم به ذکر است که مخلوط شدن این نوع اسید با آب موجب آزاد شدن مقدار قابل توجهی گرما میشود. به همین دلیل است که اسید را باید به آب اضافه کرد زیرا در غیر این صورت، اسید پاشیده میشود و آسیب بسیار زیادی وارد میکند.
تاریخچهی کشف اسید سولفوریک
کشف اسید سولفوریک به قرن سیزدهم میرسد. با این وجود، از مدتها پیش از کشف از آن به عنوان یک مادهی شیمیایی استفاده میشد. تولید این مادهی شیمیایی در مقیاس صنعتی و استفادهی گسترده از آن در صنایع مختلف در قرن هفدهم انجام گرفت. در واقع، کیمیاگران این اسید را از طریق سوزاندن گوگرد و نمک پتاسیم (نیترات نمک) به دست آوردند. اسید سولفوریک با فرمول H۲SO۴ در کنار اسید نیتریک و اسید کلریدریک از جمله اسیدهای معدنی قوی محسوب میشود.
در سال 1830، یک فرآیند کاتالیزوری برای تهیهی این مادهی شیمیایی از دی اکسید گوگرد معرفی شد. امروزه، از همین فرآیند برای ساخت این اسید بسیار قوی و خورنده در صنایع استفاده میشود.
کاربرد اسید سولفوریک در صنایع
همانطور که گفته شد، از این اسید بسیار قوی و خورنده در صنایع مختلفی استفاده میشود. تولیدکنندهی اصلی این اسید، کشورهای آسیایی و آمریکای شمالی هستند. به طور کلی، کاربردهای اسید سولفوریک را میتوان به طور خلاصه این چنین بیان کرد:
- تهیهی انواع کودهای کشاورزی
- پاککنندهی لولهها
- تهیهی مواد شویندهی مختلف
- صنایع فولاد و آهن برای رسوبزدایی
- صنعت لاستیکسازی و رزین های مصنوعی
- تهیه دارو و صنعت داروسازی
- تهیهی حشرهکشها
- ضدیخ
- باتریهای اتومبیل
- کاتالیزورهای نفتی
- رنگدانههای مختلف از جمله رنگ، مینا و جوهر چاپ.
با توجه به گستردگی کاربرد اسید سولفوریک در صنایع مختلف، نیازی شدیدی به مادهی اولیهی آن یعنی گوگرد است. در گذشته، گوگرد را از ذخایر آتشفشانی در سیسیل استخراج میکردند. اما در اوایل قرن بیستم، مشخص شد که این ذخایر کافی نیستند و باید به دنبال منبع دیگری برای استخراج گوگرد بگردند. در نتیجه، استخراج گوگرد از زیرزمین در جنوب ایالات متحده آمریکا آغاز شد و رونق بسیار زیادی گرفت.
خواص فیزیکی و شیمیایی اسید سولفوریک
اسید سولفوریک یک مایع بیرنگ است که بسته به درجه خلوص، گاهی به رنگ قهوهای تیره نیز یافت میشود. از مهمترین خواص فیزیکی و شیمیایی این اسید قوی و پرکاربرد میتوان به موارد زیر اشاره کرد:
- نقطهی جوش: 338 درجه سانتیگراد
- نقطهی انجماد: 10 درجهی سانتیگراد
- وزن مولکولی: 98 گرم بر مول
- نقطه ذوب: 100 درجه سانتیگراد
- چگالی: 1.84
- فشاربخار: 0.001 میلیمتر جیوه در 200 سی سی
اسید سولفوریک، محلول در آب است و به سرعت با آب واکنش نشان میدهد. اسید سولفوریک با غلظتهای ۷۸، ۹۳ یا ۹۸ درصد تهیه و عرضه میگردد.
روشهای تولید اسید سولفوریک
به طور کلی، فرآیند تولید این نوع اسید را میتوان به چهار مرحلهی زیر تقسیم کرد:
- استخراج گوگرد
- تبدیل گوگرد به دی اکسید گوگرد
- تبدیل دی اکسید گوگرد به تری اکسید گوگرد
- تبدیل تری اکسید گوگرد به اسید سولفوریک.
در ادامه، هر مرحله را به صورت مجزا توضیح خواهیم داد.
مرحلهی 1: استخراج گوگرد
گوگرد معمولاً از بازیابی گاز طبیعی و نفت دارای ترکیبات گوگردی استخراج میشود. با این وجود، منبع دیگر برای استخراج گوگرد، تصفیهی فلز است که منجر به تولید دی اکسید گوگرد میشود. علاوه بر این، حرارت دادن اکثر سنگ معدنهای فلزی که سولفید نامیده میشوند، به تولید دی اکسید گوگرد میانجامند به طوری که 35 درصد گوگرد مورد نیاز در سراسر جهان از این طریق به دست میآید.
مرحلهی 2: تبدیل گوگرد به دی اکسید گوگرد
گوگرد ابتدا باید به دی اکسید گوگرد تبدیل شود. برای این منظور، گوگرد مذاب را در کوره با شعلهی آبی میسوزانند. گوگرد با اکسیژن موجود در هوا واکنش میدهد و در نتیجه، گوگرد دی اکسید به دست میآید.
مرحلهی 3: تبدیل دی اکسید گوگرد به تری اکسید گوگرد
فرآیند تبدیل دی اکسید گوگرد به تری اکسید گوگرد، یک واکنش گرمازا است. به همین دلیل است که برای تهیهی تری اکسید گوگرد معمولاً از درجه حرارت پایین استفاده میشود.
مرحلهی 4: تبدیل تری اکسید گوگرد به اسید سولفوریک
مرحلهی نهایی، تبدیل تری اکسید گوگرد به این اسید است. تری اکسید گوگرد با آب واکنش میدهد و غبار آن، نتیجهی این واکنش است. معمولاً از این اسید با غلظت 98 درصد استفاده میشود.
چین تولیدکنندهی اصلی اسید سولفوریک در جهان محسوب میشود. پس از آن، آمریکا در جایگاه دوم و هند در جایگاه سوم قرار میگیرند. روسیه و مراکش نیز از دیگر کشورهای تولیدکنندهی این اسید در جهان به شمار میروند.
خطرات مرتبط با اسید سولفوریک
همانطور که گفته شد، اسید سولفوریک بسیار خورنده است و میتواند منجر به سوختگی شدید شود. علاوه بر این، تماس آن با چشمها ممکن است منجر به کوری دائمی نیز گردد. بلع این مادهی شیمیایی باعث سوختگی داخلی میشود و آسیبهای غیرقابل جبرانی را به همراه دارد.
گاهیاوقات، نیز ممکن است منجر به مرگ فرد شود. قرار گرفتن در معرض مداوم اسید سولفوریک باعث فرسودگی دندانها نیز میگردد. حتی استنشاق بخار این اسید خورنده نیز برای سلامتی بسیار مضر است و پیامدهای ناخوشایند بسیار زیادی را به همراه دارد.
به همین دلیل است که همواره توصیه میشود که از ماسک، دستکش بلند لاستیکی، چکمه، عینک ایمنی شیمیایی و محافظ صورت هنگام قرار گرفتن در معرض این مادهی شیمیایی استفاده شود.